临床试验地点选择对药企来说是一个重要的、需要多层面考量的投资决策。了解药企临床试验机构遴选标准,对决策者和监管机构吸引外来临床研发投资至关重要,这些临床研发投资将为当地人口创造经济、医疗卫生和社会价值。
IQVIA通过访谈药企负责遴选临床试验开展地点的高管和决策者,我们分析了行业趋势,提出投资标准框架,并为监管机构、医疗卫生行业政策制定者、供应商和药企提供一些可操作的建议。
临床试验全球概览
据IQVIA Institute发布的《2022年研发趋势报告》预计,2021年处方药收入排名前15位的药企的研发支出为1330亿美元,比2016年增长了44%(图1)。

临床试验为各国提供了巨大的经济和社会价值,包括帮助当地患者尽早获得新的疗法、为临床基础设施引进投资和新方法(如诊断测试)、提高医院的直接收入,以及吸引全球人才。
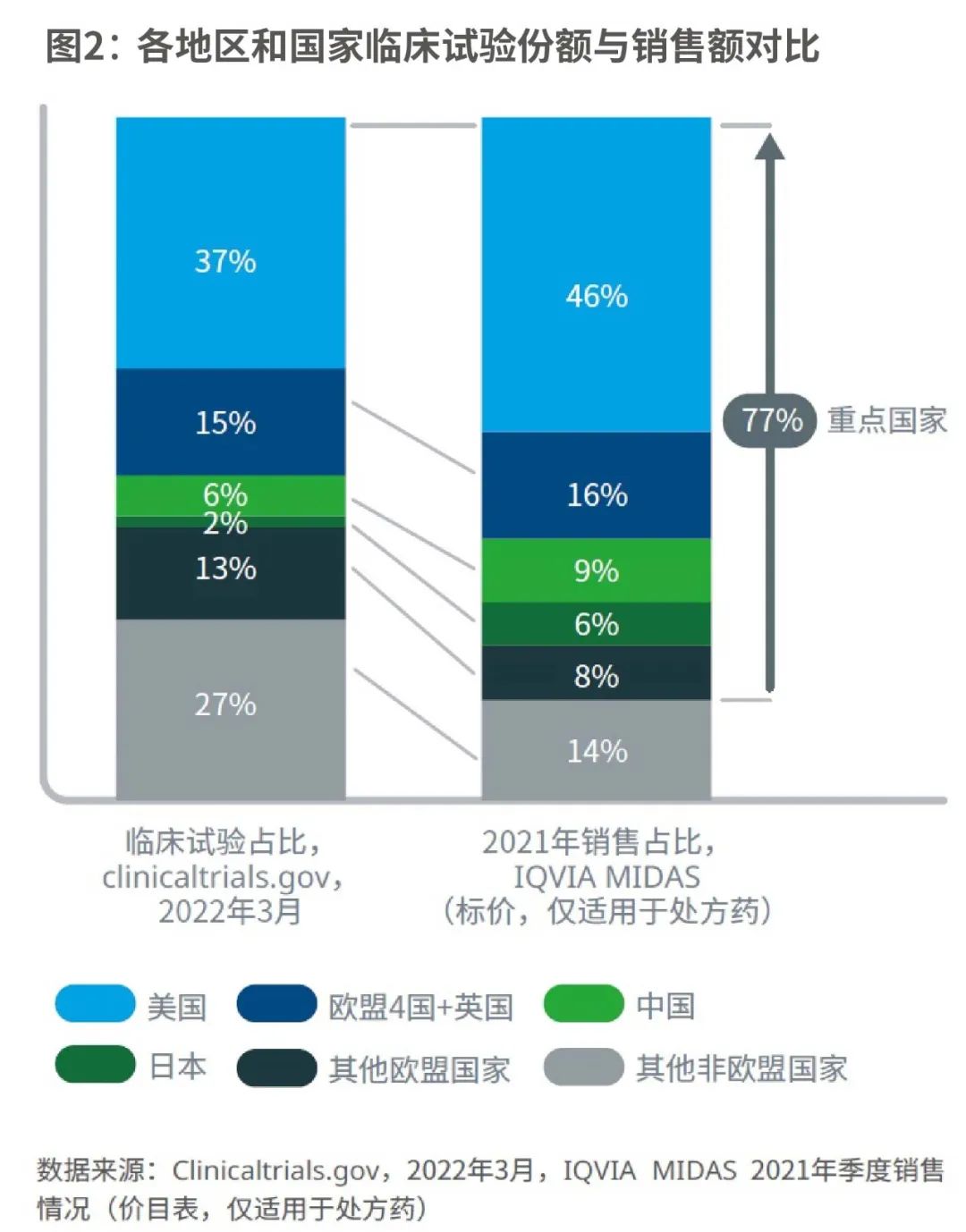
商业回报率是临床试验选点的一大决定性因素;受访者也证实,市场的商业潜力是临床试验尤其是后期临床试验选点时重要的考虑因素。但分析表明,现实情况并非完全如此。
八个公认的“重点国家”—美国、欧盟4国、英国、日本和中国,主导了60%的全球临床试验,并在2021年创造了77%的全球销售额。还有一些国家,虽然商业潜力较小,但作为临床试验的开展地,具有明显吸引力。
如东欧国家在临床研发中所占的份额比其商业潜力估值要大。由此可见,在决策过程中,除了商业潜力,还要考虑其他因素。
2、选点主要驱动因素
我们采访了多位全球临床运营和法规事务负责人,这些受访者均就职于排名前20的大型药企、欧洲中型药企和新兴生物制药公司(EBP)。
通过这些访谈,我们确定了投资驱动因素包括:疾病流行率、试验表现、专家网络和监管框架。药企对这些因素的排序取决于资产或研究,也取决于公司规模。
受访者提到,临床试验成本是考量之一,但并不是选择国家的首要因素。即 “优先考虑其他更相关的因素,如质量和速度,而不是成本”或者“成本是其他更相关因素的结果”。

3、不同国家及其吸引力
我们根据各国对临床试验吸引力的不同,定义了“重点国家”、“增长型国家”和“不在范围内国家”。

重点国家包括美国、欧盟4国、英国、日本和中国。在IQVIA Launch Excellence Series中, 这八个“重点国家”被认为是成功上市的关键。
尽管这些国家的临床试验环境竞争激烈且趋于饱和,监管要求也非常复杂且越来越严格,但药企仍将这些国家定义为“必经之路”。
有时注册和批准时间会比较长,成本也较高,但药企仍会选择在这些国家进行临床试验。
然而,在这些重点国家的临床试验投入比例正在发生变化。过去15年中,总部设在欧盟的药企研发管线份额从31%减少到25%,而中国的份额则在5年间从4%上升到12%。
中国研发管线份额的增加主要得益于政府的监管改革和对创新发展的大规模投资,而欧洲管线比例的下降可能是由于欧盟临床试验政策有碍于临床试验的发展。
美国所占份额保持不变,因为业界普遍认为FDA的政策对细胞、基因和RNA疗法创新很有利。美国不仅是世界上最有价值的医药市场,而且占创新药上市最初五年累计销售额的60%以上。
新兴生物制药公司(EBP)在全球研发管线份额中也发挥着重要作用,2021年EBP管线占所有研发管线的65%。2021年,中国的EBP公司占整个EBP创新管线的17%,较五年前的6%有了大幅提升,而同期美国和欧洲EBP公司的份额都有所下降。
4、影响和建议
受数字化、去中心化、多样性和包容性、持续创新趋势等多重复杂因素影响,临床试验经历着变革,全球临床试验投资仍会保持不断变化。药企在推动行业发展方面也发挥了重要作用。我们对企业未来开展临床试验提出的主要建议有:
- 采用开放灵活的方式选择国家和地点,发现各国的新机会和能力,并评估新的商业模式(即成本效益分析)。
- 与机构和协会积极合作,及时对话,设计创新政策(如MHRA的咨询政策)。量化当地医药行业的价值,清晰地呈现优势,如创造就业机会、为患者谋利。
- 为新计划(如EMA的ACT EU 2022)的实施持续提供支持和反馈,开拓新产品,乘着政策东风研发新产品。
- 持续完善临床试验,投资数字解决方案,解决运营瓶颈并在患者旅程方面建立竞争优势,例如,远程智能临床研究的运用可解决患者招募和保留难题,减少临床试验中的物流负担,并采用先进技术,如采用区块链和EMR高级分析等。
- 以患者为中心,将“患者的声音”作为试验过程和方案设计的积极驱动因素,并与当地机构建立强有力的合作关系,以提高洞察力,为患者旅程提供量身定制的解决方案。
- 多样性和包容性,反映真实的患者群体概况,通过实施流程和技术弥补种族和少数人群数据的代表性不足,开展更具包容性的临床试验,并在临床试验的注册和审批方面取得优势

 关注微信公众号
关注微信公众号
